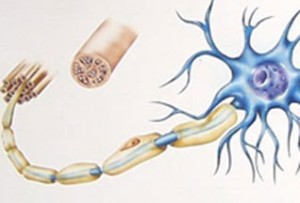
Descubierto un nuevo marcador
que podría mejorar el diagnóstico
de la esclerosis múltiple
Bernarhard Hemmer y su equipo de investigadores han identificado un nuevo biomarcador que podría ayudar a mejorar el diagnóstico de la esclerosis múltiple
Estos hallazgos, publicados recientemente en the New England Journal of Medicine, indican que el canal de potasio específico conocido como KIR4.1 podría ser una de las dianas destacadas en la respuesta inmunitaria de la esclerosis múltiple. Investigadores del Klinikum Rechts der Isar Hospital, Technische Universität München (TUM), Múnich (Alemania) han identificado en sangre de pacientes con esclerosis múltiple anticuerpos dirigidos contra este canal.
KIR4.1 se encuentra de manera primaria en la membrana de las células gliales, responsables del control metabólico cerebral y de la formación de la mielina. Tanto humanos como animales sin KIR4.1 cursan con fallo neurológico e incapacidad para coordinar el movimiento de manera adecuada. La presencia de autoanticuerpos dirigidos a KIR4.1 es muy poco frecuente en personas con otro tipo de enfermedades neurológicas, lo que convierte a este anticuerpo en un marcador diagnóstico potencial muy importante en el futuro de la esclerosis múltiple.
sábado, 29 de septiembre de 2012
sábado, 22 de septiembre de 2012
BG-12 y el acetato de glatirámero,
eficaces en EM recurrente-remitente
 Investigadores del Centro Mellen para Investigación y Tratamient0 de la
Esclerosis Múltiple, dentro de la Clínica Cleveland, en Estados Unidos, han
hallado que el dimetil fumarato (BG-12), un tratamiento oral en desarrollo para
los pacientes con esclerosis múltiple recurrente-remitente, y el acetato de
glatirámero redujeron de forma significativa las tasas de relapso y mejoraron
los resultados neurorradiológicos en relación al placebo.
Investigadores del Centro Mellen para Investigación y Tratamient0 de la
Esclerosis Múltiple, dentro de la Clínica Cleveland, en Estados Unidos, han
hallado que el dimetil fumarato (BG-12), un tratamiento oral en desarrollo para
los pacientes con esclerosis múltiple recurrente-remitente, y el acetato de
glatirámero redujeron de forma significativa las tasas de relapso y mejoraron
los resultados neurorradiológicos en relación al placebo.
DiarioMedico.com | 20/09/2012
En este estudio en fase III, randomizado, los científicos investigaron la eficacia y seguridad de BG-12, en una dosis de 240 mg dos o tres veces al día, en comparación con placebo, en pacientes con la citada enfermedad neurológica. El agente activo acetato de glatirámero también fue incluido como una referencia comparadora.
En dos años, la tasa de recurrencia anualizada fue significativamente menor con BG-12 administrado dos veces al día, tres veces al día y con acetato de glatirámero que con placebo, pero las reducciones en la progresión de la discapacidad con los fármacos no fueron significativas.
Efectos adversos
Los efectos adversos, como sofocos y problemas gastrointestinales, se dieron más frecuentemente en los pacientes con tratamiento activo con BG-12, mientras que los que recibían acetato de glatirámero sufrieron efectos secundarios relacionados con la inyección. Los autores han señalado que los participantes no sufrieron neoplasias malignas o infecciones oportunistas con BG-12. En cuanto al recuento de linfocitos, éste descendió con BG-12.
(N Engl J Med; 2012; DOI: 10.1056/NEJMos 1206328).
eficaces en EM recurrente-remitente
 Investigadores del Centro Mellen para Investigación y Tratamient0 de la
Esclerosis Múltiple, dentro de la Clínica Cleveland, en Estados Unidos, han
hallado que el dimetil fumarato (BG-12), un tratamiento oral en desarrollo para
los pacientes con esclerosis múltiple recurrente-remitente, y el acetato de
glatirámero redujeron de forma significativa las tasas de relapso y mejoraron
los resultados neurorradiológicos en relación al placebo.
Investigadores del Centro Mellen para Investigación y Tratamient0 de la
Esclerosis Múltiple, dentro de la Clínica Cleveland, en Estados Unidos, han
hallado que el dimetil fumarato (BG-12), un tratamiento oral en desarrollo para
los pacientes con esclerosis múltiple recurrente-remitente, y el acetato de
glatirámero redujeron de forma significativa las tasas de relapso y mejoraron
los resultados neurorradiológicos en relación al placebo.DiarioMedico.com | 20/09/2012
En este estudio en fase III, randomizado, los científicos investigaron la eficacia y seguridad de BG-12, en una dosis de 240 mg dos o tres veces al día, en comparación con placebo, en pacientes con la citada enfermedad neurológica. El agente activo acetato de glatirámero también fue incluido como una referencia comparadora.
En dos años, la tasa de recurrencia anualizada fue significativamente menor con BG-12 administrado dos veces al día, tres veces al día y con acetato de glatirámero que con placebo, pero las reducciones en la progresión de la discapacidad con los fármacos no fueron significativas.
Efectos adversos
Los efectos adversos, como sofocos y problemas gastrointestinales, se dieron más frecuentemente en los pacientes con tratamiento activo con BG-12, mientras que los que recibían acetato de glatirámero sufrieron efectos secundarios relacionados con la inyección. Los autores han señalado que los participantes no sufrieron neoplasias malignas o infecciones oportunistas con BG-12. En cuanto al recuento de linfocitos, éste descendió con BG-12.
(N Engl J Med; 2012; DOI: 10.1056/NEJMos 1206328).
sábado, 15 de septiembre de 2012
Jornada científica internacional en Barcelona para hablar
del futuro de la esclerosis múltiple
El objetivo de la reunión, que tuvo lugar en el Centro de Esclerosis Múltiple de Cataluña (Cemcat) el pasado viernes 14 de septiembre, fue compartir conocimientos y determinar las bases para el futuro de la investigación y la asistencia en esclerosis múltiple. La genética, la inmunología, el diagnóstico y las terapias fueron algunos de los aspectos tratados en las ponencias que reunieron a 40 expertos en esclerosis múltiple.
El Dr. José Navas, gerente del Hospital Universitario Vall d’Hebron y el Dr. Xavier Montalban, Jefe de Servicio de Neurología/Neuroinmunología del Hospital Universitario Vall d’Hebron y Director del Cemcat, fueron los encargados de abrir la jornada.
Alastair Compston, profesor y jefe del Departamento de Neurociencias Clínicas de la Universidad de Cambridge (Reino Unido), moderó la primer, que abrió el Dr. Jerry Wolinsky, profesor de Neurología del Health Science Center en la Universidad de Texas (Estados Unidos).
Wolinsky se centró en repasar los objetivos logrados en la investigación a lo largo de los últimos cuarenta años. En los setenta la atención al paciente y el diagnóstico de la EM eran muy complejos ya que no existían tratamientos eficaces ni métodos diagnósticos de apoyo al neurólogo. Como dato relevante de la década de los setenta, mencionar la irrupción de la resonancia magnética, que permitió un mejor diagnóstico.
El Dr. Wolinsky también habló de los años ochenta y destacó el avance en los criterios diagnósticos. Ya en los noventa, nace la terapia con interferón, la cual implicó un paso sustancial en contener los efectos de la enfermedad. Finalmente, el Dr. Wolinsky recordó la importancia de los factores medioambientales en la prevalencia de la esclerosis múltiple, que es superior en el hemisferio norte y entre las mujeres.
Seguidamente, el Dr. Jorge Oksenberg de la Universidad de California en San Francisco (Estados Unidos) se centró en los aspectos genéticos de la esclerosis múltiple. Oksenberg destacó que se han tenido que esperar cuarenta años para poder llegar a completar un estudio genómico completo de los pacientes con esclerosis múltiple y sus rasgos diferenciales con los individuos sin la enfermedad. Un hito resultado de un estudio internacional con la participación de 10.000 pacientes. Oksenberg enfatizó que se puede establecer el nivel de riesgo genético de cada individuo. De esta manera, una persona con antecedentes familiares en Europa del Norte tiene un riesgo genético de entre un 0,1 y un 0,2%, mientras que una persona con un familiar con esclerosis múltiple incrementa su riesgo de forma relevante.
El Dr. Reinhard Hohlfeld del Max Planck Institute de la Universidad Ludwig Maximilians de Múnich (Alemania) abundó en los hallazgos hasta el momento y en el futuro de la investigación en la inmunología de la esclerosis múltiple, la cual se basa en estudios de inmunología humana, neuropatológicos y en el modelo animal de la esclerosis múltiple, la encefalomielitis autoinmune experimental. Hohlfeld apuntó a posibles mecanismos por los cuales el tabaco se podría ver implicado en un aumento del riesgo de esclerosis múltiple.
Por su parte, el Profesor Fred Lublin del Hospital Monte Sinaí de Nueva York (Estados Unidos) abordó las controversias sobre la definición de las formas clínicas de la esclerosis múltiple (en brotes o progresivas) y propuso nuevos criterios para clasificarlas.
El Profesor Giancarlo Comi del Hospital San Raffaele de Milán (Italia) fue el encargado de moderar la segunda parte de la sesión. El diagnóstico fue el tema central de la primera ponencia de la tarde, a cargo del Profesor Chris Polman, de la Free University de Amsterdam, Holanda. Polman insistió en la importancia de la resonancia magnética y focalizó su discurso en la definición de los criterios diagnósticos, que en el futuro podrían incorporar aspectos tales como las lesiones en la corteza cerebral y los marcadores sanguíneos o de líquido cefalorraquídeo. También explicó que han lanzado desde la Free University de Amsterdam la aplicación gratuita para Smartphones ‘MS Diagnosis’ que permite, entre otras cosas, aplicar los criterios diagnósticos de la esclerosis múltiple
A continuación, el Profesor Ludwig Kappos del Departamento de Neurología y Biomedicina del Hospital Universitario de Basilea (Suiza) analizó las terapias existentes, y su adaptación a las características de cada paciente. Kappos presentó los nuevos fármacos orales y anticuerpos monoclonales. También insistió en las terapias para las formas progresivas de la enfermedad en las que aún queda camino por recorrer.
Para concluir la jornada científica, el Profesor Michael Clanet, del Complejo Hospitalario Universitario de Toulouse (Francia) y presidente de ECTRIMS, habló de los distintos modelos de organización en la atención a personas con esclerosis múltiple y destacó las diferencias del coste de esta atención entre los distintos países europeos, subrayando la variación entre los componentes de este coste (directos médicos, indirectos sociales e intangibles).
del futuro de la esclerosis múltiple
El objetivo de la reunión, que tuvo lugar en el Centro de Esclerosis Múltiple de Cataluña (Cemcat) el pasado viernes 14 de septiembre, fue compartir conocimientos y determinar las bases para el futuro de la investigación y la asistencia en esclerosis múltiple. La genética, la inmunología, el diagnóstico y las terapias fueron algunos de los aspectos tratados en las ponencias que reunieron a 40 expertos en esclerosis múltiple.
El Dr. José Navas, gerente del Hospital Universitario Vall d’Hebron y el Dr. Xavier Montalban, Jefe de Servicio de Neurología/Neuroinmunología del Hospital Universitario Vall d’Hebron y Director del Cemcat, fueron los encargados de abrir la jornada.
Alastair Compston, profesor y jefe del Departamento de Neurociencias Clínicas de la Universidad de Cambridge (Reino Unido), moderó la primer, que abrió el Dr. Jerry Wolinsky, profesor de Neurología del Health Science Center en la Universidad de Texas (Estados Unidos).
Wolinsky se centró en repasar los objetivos logrados en la investigación a lo largo de los últimos cuarenta años. En los setenta la atención al paciente y el diagnóstico de la EM eran muy complejos ya que no existían tratamientos eficaces ni métodos diagnósticos de apoyo al neurólogo. Como dato relevante de la década de los setenta, mencionar la irrupción de la resonancia magnética, que permitió un mejor diagnóstico.
El Dr. Wolinsky también habló de los años ochenta y destacó el avance en los criterios diagnósticos. Ya en los noventa, nace la terapia con interferón, la cual implicó un paso sustancial en contener los efectos de la enfermedad. Finalmente, el Dr. Wolinsky recordó la importancia de los factores medioambientales en la prevalencia de la esclerosis múltiple, que es superior en el hemisferio norte y entre las mujeres.
Seguidamente, el Dr. Jorge Oksenberg de la Universidad de California en San Francisco (Estados Unidos) se centró en los aspectos genéticos de la esclerosis múltiple. Oksenberg destacó que se han tenido que esperar cuarenta años para poder llegar a completar un estudio genómico completo de los pacientes con esclerosis múltiple y sus rasgos diferenciales con los individuos sin la enfermedad. Un hito resultado de un estudio internacional con la participación de 10.000 pacientes. Oksenberg enfatizó que se puede establecer el nivel de riesgo genético de cada individuo. De esta manera, una persona con antecedentes familiares en Europa del Norte tiene un riesgo genético de entre un 0,1 y un 0,2%, mientras que una persona con un familiar con esclerosis múltiple incrementa su riesgo de forma relevante.
El Dr. Reinhard Hohlfeld del Max Planck Institute de la Universidad Ludwig Maximilians de Múnich (Alemania) abundó en los hallazgos hasta el momento y en el futuro de la investigación en la inmunología de la esclerosis múltiple, la cual se basa en estudios de inmunología humana, neuropatológicos y en el modelo animal de la esclerosis múltiple, la encefalomielitis autoinmune experimental. Hohlfeld apuntó a posibles mecanismos por los cuales el tabaco se podría ver implicado en un aumento del riesgo de esclerosis múltiple.
Por su parte, el Profesor Fred Lublin del Hospital Monte Sinaí de Nueva York (Estados Unidos) abordó las controversias sobre la definición de las formas clínicas de la esclerosis múltiple (en brotes o progresivas) y propuso nuevos criterios para clasificarlas.
El Profesor Giancarlo Comi del Hospital San Raffaele de Milán (Italia) fue el encargado de moderar la segunda parte de la sesión. El diagnóstico fue el tema central de la primera ponencia de la tarde, a cargo del Profesor Chris Polman, de la Free University de Amsterdam, Holanda. Polman insistió en la importancia de la resonancia magnética y focalizó su discurso en la definición de los criterios diagnósticos, que en el futuro podrían incorporar aspectos tales como las lesiones en la corteza cerebral y los marcadores sanguíneos o de líquido cefalorraquídeo. También explicó que han lanzado desde la Free University de Amsterdam la aplicación gratuita para Smartphones ‘MS Diagnosis’ que permite, entre otras cosas, aplicar los criterios diagnósticos de la esclerosis múltiple
A continuación, el Profesor Ludwig Kappos del Departamento de Neurología y Biomedicina del Hospital Universitario de Basilea (Suiza) analizó las terapias existentes, y su adaptación a las características de cada paciente. Kappos presentó los nuevos fármacos orales y anticuerpos monoclonales. También insistió en las terapias para las formas progresivas de la enfermedad en las que aún queda camino por recorrer.
Para concluir la jornada científica, el Profesor Michael Clanet, del Complejo Hospitalario Universitario de Toulouse (Francia) y presidente de ECTRIMS, habló de los distintos modelos de organización en la atención a personas con esclerosis múltiple y destacó las diferencias del coste de esta atención entre los distintos países europeos, subrayando la variación entre los componentes de este coste (directos médicos, indirectos sociales e intangibles).
Acerca del Centro de Esclerosis Múltiple de Cataluña (Cemcat)
El Cemcat es un centro del Institut Català de la Salut creado en Cataluña y situado en el recinto del Hospital Universitario Vall d’Hebron (HUVH), dedicado a las enfermedades Neuroinmunológicas, más específicamente la Esclerosis Múltiple (EM), y está compuesta por una unidad de Neuroinmunología Clínica (HUVH) y otra de Neurorrehabilitación (Fundación Esclerosis Múltiple (FEM)) con más de 60 profesionales especializados que sirven a unas 4.000 personas con EM. Sus valores centrales se hallan en la excelencia clínica, en investigación y en docencia con el objetivo de conseguir la máxima calidad de vida, en términos de salud, para las personas con EM y sus familias.
jueves, 13 de septiembre de 2012
La esclerosis múltiple es
accionada por “control remoto”
Las enfermedades autoinmunes son provocadas por células inmunes que atacan a los tejidos del propio cuerpo. En la esclerosis múltiple (EM) las células inmunes tienen éxito en la invasión de tejido nervioso y desencadenan una inflamación destructiva que puede ser acompañado por déficits neurológicos tales como parálisis y defectos somatosensoriales.
Un cerebro sano está prácticamente libre de células inmunes, debido a que el sistema nervioso se separa del resto del cuerpo a través de los vasos sanguíneos especializados que impiden las células inmunes de entrar en él por la sangre.
Hasta ahora no ha quedado claro cómo las células inmunes en la EM pueden superar esta barrera y aparentemente pasan sin obstáculos en el tejido cerebral. Un equipo de investigación, inicialmente en el Instituto Max Planck de Neurobiología en Martinsried, y más tarde en la Universidad de Göttingen, ahora podría demostrar que estas células causantes de enfermedades inmunes se programan en el pulmón a ser más móviles y rompen las barreras de manera eficiente de los vasos sanguíneos.
Células inmunes especializadas, las células T así llamados, se llevan a cabo para ser la causa de la EM. A pesar de que casi cada puertos humanos sanos potencialmente patógenas células T en su sistema inmune, sólo alrededor del 0,1% de la población desarrolla realmente un manifiesto de MS.
Una de las razones para esto es que las células T normalmente se detienen entre en el cerebro por una barrera vascular prácticamente impermeable que separa el sistema nervioso central 2/3 de la circulación de la sangre.
“El trabajo inicial en la investigación experimental MS mostró que cuando las células T son pre-activado fuera del tejido nervioso son muy bien pueden pasar en el cerebro y provocar síntomas similares a la EM allí”, explica Alexander Flügel, ahora jefe del Departamento de Neuroinmunología y el Instituto para la esclerosis múltiple, University Medical Center, Göttingen. “Sin embargo, hemos querido averiguar exactamente en qué parte del cuerpo, estas células T son activadas y exactamente las propiedades que les permitan superar la barrera sangre-cerebro.” Los científicos que trabajan en el Centro Médico Universitario de Göttingen inicialmente descubierto que la enfermedad-causando que las células T no puede entrar en el cerebro inmediatamente después de la activación, sino que tiene que “aprender” a hacerlo.
Durante este proceso de aprendizaje completamente las células T se re-Gear. Ellos dejan de dividirse y estrangular a su producción de la inflamación de las proteínas que fomentan. En su lugar, están programados para la migración: se vuelven más móviles, y receptores especializados aparecen en sus membranas superficiales. Estos receptores son como antenas que permiten un poco de células T a orientarse al recoger señales de su entorno y de adherirse a las superficies.
Los científicos Göttingen descubrieran que el receptor Ninjurin 1, previamente desconocida de tener relevancia a las células T, controla la capacidad de las células T para adherirse a la parte interna de los vasos sanguíneos del cerebro y por lo tanto es de gran importancia para la migración de las células T a partir la sangre en el tejido nervioso. Una vez que las células T llegan en el tejido nervioso, este programa se invierte: las células T están reactivadas inmigrantes y producen mediadores inflamatorios que establecen los procesos autoinmunes y dañan el tejido en movimiento típico de EM.
Pero de qué parte del cuerpo son las células T programadas para la migración?
Los científicos de Gotinga también podría hacer descubrimientos nuevos e inesperados sobre esta cuestión. Ellos encontraron que las células T activadas migran directamente de la circulación en el pulmón. Una vez en el tejido pulmonar de las células se mueven hacia adelante con velocidad creciente a lo largo de sus vasos sanguíneos y las vías respiratorias para llegar a los ganglios linfáticos adyacentes desde donde vuelven a entrar en la circulación de la sangre y el bazo y en última instancia, invaden el sistema nervioso.
Curiosamente, células T en el pulmón no sólo se arrastran a lo largo de la superficie exterior de los tubos bronquiales, sino también rastrean rápidamente a lo largo de las superficies interiores de las vías respiratorias. Usando una técnica especial en microscópico los investigadores pudieron observar en el tejido vivo del pulmón de las células T utilizando los tubos bronquiales como un tipo de carretera.
Y de hecho, cuando las células T activadas se introducen directamente en las vías respiratorias estas son capaces de establecer un proceso de la enfermedad autoinmune en movimiento.
Es también aquí en el pulmón donde los pasos decisivos tendrán lugar a la programación de las células que causan la enfermedad-T en un modo migratoria. La relevancia directa de estos resultados para la enfermedad humana EM reside en la posibilidad de que las infecciones del tracto respiratorio y / o irritantes de los pulmones, por ejemplo, fumar, pueden desencadenar ataques de la enfermedad.
Los científicos de este estudio descubrieran células autoagressivas potencialmente a largo plazo en el pulmón como células de memoria inmunológica. Cuando se estimula a nivel local, estas “células durmientes” se convirtió en activo: Emigraron al cerebro y desencadenó una enfermedad tipo MS allí. El papel clave del pulmón en la activación y la reprogramación causante de la enfermedad Las células T también podrían ser válidos para otros sistemas de órganos tales como el intestino o del tracto urinario, aunque quizás menos espectacular.
Análisis genéticos recientes integrales podrían identificar diversos genes en personas que sufren de MS que hizo que estas personas más susceptibles a la enfermedad.
“De manera interesante, un número significativo de estos genes eran los mismos que los encontrados en el estudio actual para participar en la programación migratorio de las células T”, dice Alexander Flügel.
El objetivo de estudios adicionales por lo tanto será encontrar los genes de la programación migratorio que son adecuados como dianas terapéuticas.
accionada por “control remoto”
Las enfermedades autoinmunes son provocadas por células inmunes que atacan a los tejidos del propio cuerpo. En la esclerosis múltiple (EM) las células inmunes tienen éxito en la invasión de tejido nervioso y desencadenan una inflamación destructiva que puede ser acompañado por déficits neurológicos tales como parálisis y defectos somatosensoriales.
Un cerebro sano está prácticamente libre de células inmunes, debido a que el sistema nervioso se separa del resto del cuerpo a través de los vasos sanguíneos especializados que impiden las células inmunes de entrar en él por la sangre.
Hasta ahora no ha quedado claro cómo las células inmunes en la EM pueden superar esta barrera y aparentemente pasan sin obstáculos en el tejido cerebral. Un equipo de investigación, inicialmente en el Instituto Max Planck de Neurobiología en Martinsried, y más tarde en la Universidad de Göttingen, ahora podría demostrar que estas células causantes de enfermedades inmunes se programan en el pulmón a ser más móviles y rompen las barreras de manera eficiente de los vasos sanguíneos.
Células inmunes especializadas, las células T así llamados, se llevan a cabo para ser la causa de la EM. A pesar de que casi cada puertos humanos sanos potencialmente patógenas células T en su sistema inmune, sólo alrededor del 0,1% de la población desarrolla realmente un manifiesto de MS.
Una de las razones para esto es que las células T normalmente se detienen entre en el cerebro por una barrera vascular prácticamente impermeable que separa el sistema nervioso central 2/3 de la circulación de la sangre.
“El trabajo inicial en la investigación experimental MS mostró que cuando las células T son pre-activado fuera del tejido nervioso son muy bien pueden pasar en el cerebro y provocar síntomas similares a la EM allí”, explica Alexander Flügel, ahora jefe del Departamento de Neuroinmunología y el Instituto para la esclerosis múltiple, University Medical Center, Göttingen. “Sin embargo, hemos querido averiguar exactamente en qué parte del cuerpo, estas células T son activadas y exactamente las propiedades que les permitan superar la barrera sangre-cerebro.” Los científicos que trabajan en el Centro Médico Universitario de Göttingen inicialmente descubierto que la enfermedad-causando que las células T no puede entrar en el cerebro inmediatamente después de la activación, sino que tiene que “aprender” a hacerlo.
Durante este proceso de aprendizaje completamente las células T se re-Gear. Ellos dejan de dividirse y estrangular a su producción de la inflamación de las proteínas que fomentan. En su lugar, están programados para la migración: se vuelven más móviles, y receptores especializados aparecen en sus membranas superficiales. Estos receptores son como antenas que permiten un poco de células T a orientarse al recoger señales de su entorno y de adherirse a las superficies.
Los científicos Göttingen descubrieran que el receptor Ninjurin 1, previamente desconocida de tener relevancia a las células T, controla la capacidad de las células T para adherirse a la parte interna de los vasos sanguíneos del cerebro y por lo tanto es de gran importancia para la migración de las células T a partir la sangre en el tejido nervioso. Una vez que las células T llegan en el tejido nervioso, este programa se invierte: las células T están reactivadas inmigrantes y producen mediadores inflamatorios que establecen los procesos autoinmunes y dañan el tejido en movimiento típico de EM.
Pero de qué parte del cuerpo son las células T programadas para la migración?
Los científicos de Gotinga también podría hacer descubrimientos nuevos e inesperados sobre esta cuestión. Ellos encontraron que las células T activadas migran directamente de la circulación en el pulmón. Una vez en el tejido pulmonar de las células se mueven hacia adelante con velocidad creciente a lo largo de sus vasos sanguíneos y las vías respiratorias para llegar a los ganglios linfáticos adyacentes desde donde vuelven a entrar en la circulación de la sangre y el bazo y en última instancia, invaden el sistema nervioso.
Curiosamente, células T en el pulmón no sólo se arrastran a lo largo de la superficie exterior de los tubos bronquiales, sino también rastrean rápidamente a lo largo de las superficies interiores de las vías respiratorias. Usando una técnica especial en microscópico los investigadores pudieron observar en el tejido vivo del pulmón de las células T utilizando los tubos bronquiales como un tipo de carretera.
Y de hecho, cuando las células T activadas se introducen directamente en las vías respiratorias estas son capaces de establecer un proceso de la enfermedad autoinmune en movimiento.
Es también aquí en el pulmón donde los pasos decisivos tendrán lugar a la programación de las células que causan la enfermedad-T en un modo migratoria. La relevancia directa de estos resultados para la enfermedad humana EM reside en la posibilidad de que las infecciones del tracto respiratorio y / o irritantes de los pulmones, por ejemplo, fumar, pueden desencadenar ataques de la enfermedad.
Los científicos de este estudio descubrieran células autoagressivas potencialmente a largo plazo en el pulmón como células de memoria inmunológica. Cuando se estimula a nivel local, estas “células durmientes” se convirtió en activo: Emigraron al cerebro y desencadenó una enfermedad tipo MS allí. El papel clave del pulmón en la activación y la reprogramación causante de la enfermedad Las células T también podrían ser válidos para otros sistemas de órganos tales como el intestino o del tracto urinario, aunque quizás menos espectacular.
Análisis genéticos recientes integrales podrían identificar diversos genes en personas que sufren de MS que hizo que estas personas más susceptibles a la enfermedad.
“De manera interesante, un número significativo de estos genes eran los mismos que los encontrados en el estudio actual para participar en la programación migratorio de las células T”, dice Alexander Flügel.
El objetivo de estudios adicionales por lo tanto será encontrar los genes de la programación migratorio que son adecuados como dianas terapéuticas.
Aubagio de Sanofi para esclerosis
múltiple logra aprobación EEUU
jueves 13 Septiembre 2012 - Reuters
Sanofi SA logró la aprobación en Estados Unidos de su píldora Aubagio para la esclerosis múltiple, uno de dos tratamientos para la enfermedad crónica que podrían encarrilar las ventas del laboratorio francés tras varios medicamentos superventas que perdieron la protección de patentes.
El fármaco de Sanofi SA ha demostrado ser menos eficaz que algunos de sus rivales, pero tiene pocos efectos secundarios y los analistas dicen que podría se preferido por pacientes recién diagnosticados.
Entre un 35 y un 40 por ciento de las personas que sufren esclerosis múltiple (EM) prefiere no tomar medicamentos para no enfrentar efectos secundarios no deseados.
"En un ensayo clínico, la tasa de recaída de los pacientes que utilizaron Aubagio fue aproximadamente 30 por ciento menor que la de los que tomaron un placebo", dijo en un comunicado Russell Katz, director de la División de Productos de Neurología de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés).
Se espera que Aubagio llegue al mercado estadounidense en las próximas semanas, dijo una portavoz de la unidad Genzyme de Sanofi.
La esclerosis múltiple, que no tiene cura, afecta a 2,5 millones de personas en todo el mundo. Es una enfermedad crónica, a menudo incapacitante, que ataca el sistema nervioso central y puede causar insensibilidad en los órganos, parálisis y pérdida de la visión.
Se espera que el medicamento Gilenya de Novartis AG y el BG-12 de Biogen Idec Inc dominen un mercado que a juicio de analistas de JPMorgan crecería hasta los 14.000 millones dólares en el 2015 desde los 9.600 millones de dólares del año pasado.
Se prevé que Aubagio capte un pedazo mucho más pequeño de este mercado, alcanzando unas ventas de 353 millones de dólares en Estados Unidos y en los cinco países más importantes de Europa en el 2020, según la firma de investigación de negocios Datamonitor.
El analista de Cheuvreux Marcel Brand tiene un pronóstico más optimista y predijo ventas máximas del Aubagio por 1.480 millones de euros en el 2018.
"Aunque Aubagio no es tan eficaz en las tasas de recaída como Gilenya, libera de efectos secundarios a largo plazo", dijo.
(Reporte de Elena Berton en París y Tej Sapru, Sunayan Bhattacharjee en Bangalore)
miércoles, 5 de septiembre de 2012
El genoma, descifrado
Josep Corbella - 05/09/2012 - LaVanguardia.com - Barcelona
Después de nueve años de trabajo, los líderes del consorcio científico internacional Encode presentaron ayer los esperados resultados que explican cómo funciona el genoma humano.
Sus conclusiones demuestran que por lo menos el 80% del genoma está activo en por lo menos algún tipo de célula del organismo.
Este descubrimiento echa por tierra la idea vigente hasta ahora de que la mayor parte del genoma está formado por residuos genéticos sin utilidad, a los que despectivamente se llamaba ADN basura. Este ADN basura, se demuestra ahora, tiene en realidad un gran valor, ya que regula cómo funcionan los genes. De él depende que los genes adecuados se activen en el momento adecuado en las células adecuadas y que, por ejemplo, una célula de hígado funcione como una célula de hígado y que una neurona funcione como una neurona.
En este 80% largo del genoma que ahora sale a la luz se han encontrado alteraciones genéticas relacionadas con un gran número de enfermedades. Si en el pasado no se sabía cómo interpretar las alteraciones en regiones del genoma que se consideraban inactivas, ahora queda claro que pueden producir averías en el funcionamiento de las células.
Entre las más de 400 enfermedades que científicos del consorcio Encode ya han relacionado con alteraciones en estas regiones del genoma, destacan dolencias cuyo origen era un enigma como la diabetes tipo 1, la esclerosis múltiple, la artritis reumatoide, la enfermedad de Crohn o algunos casos de cáncer de mama. También rasgos hereditarios como la altura de una persona o la edad a la que sale el primer diente están regulados por estas regiones del genoma en las que no hay genes –o, por lo menos, genes en el sentido clásico-.
“Vamos a tener que redefinir lo que es un gen, que es uno de los conceptos más fundamentales de la biología”, destaca Roderic Guigó, bioinformático del Centre de Regulació Genòmica (CRG) y de la Universitat Pompeu Fabra y uno de los 24 investigadores principales del proyecto.
Según la visión clásica, el ADN está organizado de manera lineal como un hilo y un gen es un fragmento de este hilo que contiene las instrucciones para producir una proteína. Pero en la realidad el ADN está enrollado como un ovillo en el núcleo de las células. Según la visión que emerge del proyecto Encode, regiones de ADN que estarían alejadas si el ovillo se desenrollara se encuentran tan cerca que interactúan entre ellas. Encode, así, cambia la visión unidimensional del hilo por la visión tridimensional del ovillo, más compleja y más ajustada a la realidad.
El proyecto Encode se lanzó en el 2003 después de que el proyecto Genoma Humano llegara a las desconcertantes conclusiones de que el ADN humano solo contiene unos 20.000 genes y que solo representan el 2% de todo el genoma.
Aunque el proyecto Genoma Humano fue presentado en su día como un hito en la historia de la ciencia que iba a revolucionar la medicina, una década más tarde las aplicaciones médicas del genoma son mínimas. La mayor parte de los intentos por localizar las causas de enfermedades complejar en estos genes, de hecho, han fracasado.
“No es que el proyecto Genoma estuviera mal planteado”, aclara Guigó. Pero “las técnicas de análisis del genoma que tenemos ahora son mucho más potentes que las que teníamos hace diez años, lo cual nos ha permitido descubrir detalles que antes se nos escapaban. Ha sido como pasar de examinar el genoma con unas lentes desenfocadas a examinarlo en alta resolución”.
Encode se propuso identificar todos los elementos funcionales que hay en el genoma humano, estuvieran ubicados en un gen o no. Los primeros cuatro años se dedicaron a una fase piloto en la que se desarrollaron las herramientas y las infraestructuras para llevar a cabo la investigación y en la que se analizó solo el 1% del genoma. En los últimos cinco años, se ha extendido al 99% restante.
Prueba de la magnitud del proyecto es que en él han participado 442 investigadores de 32 instituciones, que han estudiado la actividad del genoma completo en 147 tipos distintos de células humanas. Los principales resultados de la investigación se presentaron ayer en 32 artículos científicos en las revistas Nature, Science, Genome Biology y Genome Research. Estos artículos, así como todos los datos generados por el proyecto Encode, son de libre acceso para cualquier científico de cualquier lugar del mundo. “El objetivo es que cualquiera pueda desarrollar nuevas investigaciones a partir de los datos de Encode; aún nos queda mucho por descubrir”, explica Guigó.
Por ahora, los investigadores del consorcio han identificado cuatro millones de regiones del genoma que regulan la actividad de los aproximadamente 20.000 genes humanos. Estas regiones actúan como interruptores que indican cuándo un gen debe estar activo o inactiva.
Se comprende ahora por qué los intentos de buscar las causas genéticas de un gran número de enfermedades han fracasado en los últimos años. La situación es equivalente a tener una lámpara que no funciona en una casa. Los investigadores habían estado examinando la lámpara y no le había encontrado ninguna avería, porque en realidad la avería estaba en alguno de los múltiples interruptores que la controlan.
Al aclarar cuáles son los interruptores que controlan cada gen, el proyecto Encode abre la vía a investigar las causas de enfermedades aún mal comprendidas y a mejorar su prevención, su detección precoz y su tratamiento.
Sus conclusiones demuestran que por lo menos el 80% del genoma está activo en por lo menos algún tipo de célula del organismo.
Este descubrimiento echa por tierra la idea vigente hasta ahora de que la mayor parte del genoma está formado por residuos genéticos sin utilidad, a los que despectivamente se llamaba ADN basura. Este ADN basura, se demuestra ahora, tiene en realidad un gran valor, ya que regula cómo funcionan los genes. De él depende que los genes adecuados se activen en el momento adecuado en las células adecuadas y que, por ejemplo, una célula de hígado funcione como una célula de hígado y que una neurona funcione como una neurona.
En este 80% largo del genoma que ahora sale a la luz se han encontrado alteraciones genéticas relacionadas con un gran número de enfermedades. Si en el pasado no se sabía cómo interpretar las alteraciones en regiones del genoma que se consideraban inactivas, ahora queda claro que pueden producir averías en el funcionamiento de las células.
Entre las más de 400 enfermedades que científicos del consorcio Encode ya han relacionado con alteraciones en estas regiones del genoma, destacan dolencias cuyo origen era un enigma como la diabetes tipo 1, la esclerosis múltiple, la artritis reumatoide, la enfermedad de Crohn o algunos casos de cáncer de mama. También rasgos hereditarios como la altura de una persona o la edad a la que sale el primer diente están regulados por estas regiones del genoma en las que no hay genes –o, por lo menos, genes en el sentido clásico-.
“Vamos a tener que redefinir lo que es un gen, que es uno de los conceptos más fundamentales de la biología”, destaca Roderic Guigó, bioinformático del Centre de Regulació Genòmica (CRG) y de la Universitat Pompeu Fabra y uno de los 24 investigadores principales del proyecto.
Según la visión clásica, el ADN está organizado de manera lineal como un hilo y un gen es un fragmento de este hilo que contiene las instrucciones para producir una proteína. Pero en la realidad el ADN está enrollado como un ovillo en el núcleo de las células. Según la visión que emerge del proyecto Encode, regiones de ADN que estarían alejadas si el ovillo se desenrollara se encuentran tan cerca que interactúan entre ellas. Encode, así, cambia la visión unidimensional del hilo por la visión tridimensional del ovillo, más compleja y más ajustada a la realidad.
El proyecto Encode se lanzó en el 2003 después de que el proyecto Genoma Humano llegara a las desconcertantes conclusiones de que el ADN humano solo contiene unos 20.000 genes y que solo representan el 2% de todo el genoma.
Aunque el proyecto Genoma Humano fue presentado en su día como un hito en la historia de la ciencia que iba a revolucionar la medicina, una década más tarde las aplicaciones médicas del genoma son mínimas. La mayor parte de los intentos por localizar las causas de enfermedades complejar en estos genes, de hecho, han fracasado.
“No es que el proyecto Genoma estuviera mal planteado”, aclara Guigó. Pero “las técnicas de análisis del genoma que tenemos ahora son mucho más potentes que las que teníamos hace diez años, lo cual nos ha permitido descubrir detalles que antes se nos escapaban. Ha sido como pasar de examinar el genoma con unas lentes desenfocadas a examinarlo en alta resolución”.
Encode se propuso identificar todos los elementos funcionales que hay en el genoma humano, estuvieran ubicados en un gen o no. Los primeros cuatro años se dedicaron a una fase piloto en la que se desarrollaron las herramientas y las infraestructuras para llevar a cabo la investigación y en la que se analizó solo el 1% del genoma. En los últimos cinco años, se ha extendido al 99% restante.
Prueba de la magnitud del proyecto es que en él han participado 442 investigadores de 32 instituciones, que han estudiado la actividad del genoma completo en 147 tipos distintos de células humanas. Los principales resultados de la investigación se presentaron ayer en 32 artículos científicos en las revistas Nature, Science, Genome Biology y Genome Research. Estos artículos, así como todos los datos generados por el proyecto Encode, son de libre acceso para cualquier científico de cualquier lugar del mundo. “El objetivo es que cualquiera pueda desarrollar nuevas investigaciones a partir de los datos de Encode; aún nos queda mucho por descubrir”, explica Guigó.
Por ahora, los investigadores del consorcio han identificado cuatro millones de regiones del genoma que regulan la actividad de los aproximadamente 20.000 genes humanos. Estas regiones actúan como interruptores que indican cuándo un gen debe estar activo o inactiva.
Se comprende ahora por qué los intentos de buscar las causas genéticas de un gran número de enfermedades han fracasado en los últimos años. La situación es equivalente a tener una lámpara que no funciona en una casa. Los investigadores habían estado examinando la lámpara y no le había encontrado ninguna avería, porque en realidad la avería estaba en alguno de los múltiples interruptores que la controlan.
Al aclarar cuáles son los interruptores que controlan cada gen, el proyecto Encode abre la vía a investigar las causas de enfermedades aún mal comprendidas y a mejorar su prevención, su detección precoz y su tratamiento.
Suscribirse a:
Entradas (Atom)